合作还是单干?浅谈伴随诊断开发的商业模式
更新时间:2017-09-14 作者:中原医疗器械城

FDA于2014年7月发布了《体外诊断测试产业指南》,旨在帮助药企在早期的药物研发中确定是否需要伴随诊断以及是否需要制定药物和伴随诊断的联合开发计划。
而到了2016年7月,FDA发布了指南草案——《体外伴随诊断设备与治疗产品的共同开发指导原则》,该文件旨在成为一份能够帮助药企和诊断公司更好地进行“药物-诊断(Rx-Dx)”合作开发的指南。至此,FDA的立场其实已经相对清晰地支持Rx-Dx共同开发的方案,即在药物研发的最早期阶段就确定需要开发的伴随诊断,两者同时开发并同时进入市场。
一般来说,Rx-Dx组合开发至少有三种商业模式:独立模式(Stand-alone model)、合伙模式(Partnership model)以及一站式服务(One step shop model)。
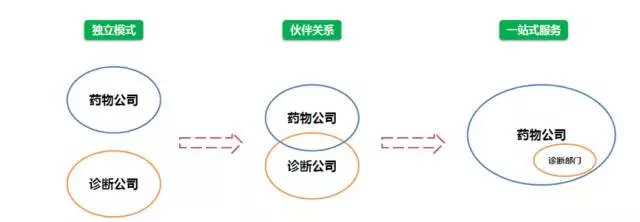
药物-伴随诊断组合开发的三种商业模式
如果单纯从公司发展历程的角度上来看,这三种模式可以存在一定的演进关系,当公司规模发展到了一定程度之后,财政资源、产品研发和临床试验、销售能力等限制因素不再是问题,如罗氏,一站式服务的开发模式就成为了最优的选择。
然而,对于大多数公司来说,合伙模式仍然是目前最佳的选择,因为诊断公司可以单独开发伴随诊断试验,但是对其而言,与药物相关的临床效果更为重要,因此不可能离开药物而谈伴随诊断。
一站式服务
一部分如罗氏和雅培这样的制药公司,具有自己内部的诊断部门和专门的诊断设备,有能力和资源在内部就用于生物标记物的发现和伴随诊断的开发。
公司在建立起足够的体量和实力之后,内部的伴随诊断能力往往通过三种方式来实现:
1、组建内部的诊断部门,配合药物研发过程中伴随诊断的开发;
2、通过交易得到研发中的产品或者收购其他公司来获得;
3、与具有诊断工具的公司开展合作,以引入与诊断有关的专业知识。
从战略合作的角度上来说,两家公司因为存在共同的目标或者利益相关而相互合作,但是仍会有很多因素影响彼此的合作。对制药公司来说,与诊断公司合作开发是为了降低研发成本和商业风险,而不稳定的合作关系同样会带来商业风险,短暂的战略合作让制药公司没有太多时间来巩固自己的诊断专业技术。
从这个角度上来讲,拥有自己的伴随诊断部门,配合药物研发,不仅省去了与合作伙伴之间可能略为繁琐的流程延迟,提高了研发的效率,而且也降低了合作关系可能带来的隐患,是大型制药公司的更优选项。
目前FDA批准的36个伴随诊断产品中,罗氏占了6个,如果算上其于2008年收购的Ventana公司的四个产品,则总共是10个,傲视群雄,足见其在体外诊断领域的龙头地位。

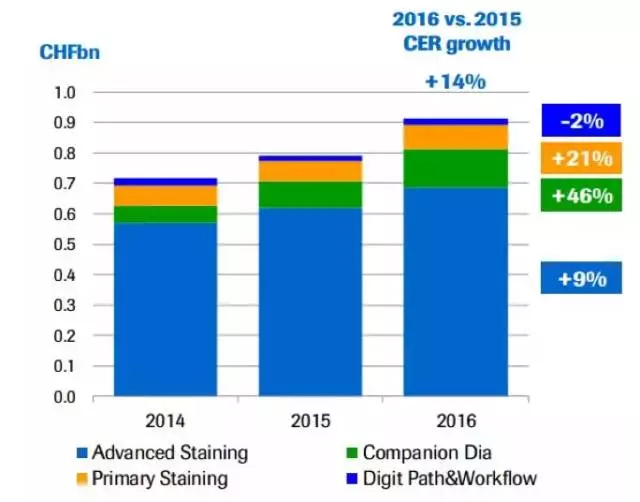
罗氏的诊断部门2016营收115亿瑞士法郎,占了整体业务的23%。组织诊断业务逐年递增,其中伴随诊断更是达到了46%的增速。
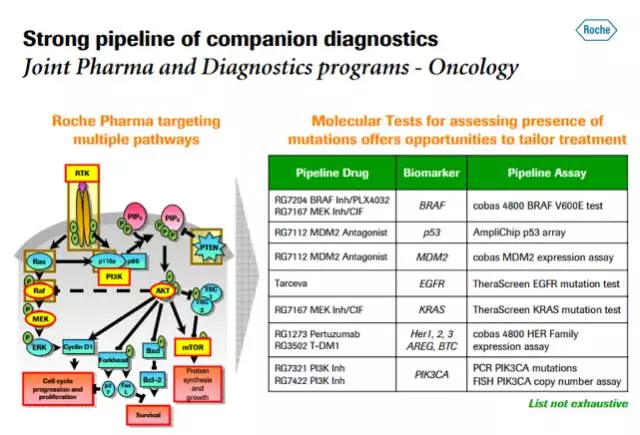
罗氏诊断管线中部分组合开发的产品
合伙模式
对于大部分公司来说,不具备这样的实力去获得自己的诊断能力,从投入和效益的权衡上面来讲,合伙模式才是更好的选择。这部分公司会通过与专门从事分子诊断的公司或合约研究机构(CRO)建立战略合作关系,获得必要的诊断专业技术。
固然,诊断公司也可以单独开发伴随诊断,但是伴随诊断的独立临床试验成本是很高的,而且对于伴随诊断来说,证实其与某种特殊药物相关的临床效果至关重要,不可能离开药物谈疗效,药物失败,伴随诊断也无法进入市场。
因此,与制药公司的合作对诊断公司来说显得更加重要,不仅能够分担诊断开发的风险和成本,而且可以确保其产品的销售与伴随药物销售相结合。制药公司一般具有较大的经销网络,能够通过诊断公司进行杠杆调节,确保产品在销售网络内的供应,同时推动诊断产品的销售。
总体上来说,合作模式的回报高于风险,因此一些公司还是会采取这一模式。

今年6月30日,FDA宣布批准Illumina公司与安进公司( Amgen)基于MiSeqDx平台合作开发的伴随诊断试剂盒(Extended RAS Panel),该panel可以检测KRAS(鼠类肉瘤病毒癌基因)和NRAS基因中的56个变异,以确定转移性结直肠癌患者是否会从安进公司的Vectibix(帕尼单抗)的获益。这是FDA批准的又一款基于NGS的伴随诊断产品。
除了Amgen之外,2014年开始Illumina还与Astra Zeneca、Merck Serono和Sanofi等公司合作来开发一种通用的肿瘤学检测系统,并致力于将其推向全球性的市场。