千呼万唤!《中国橙皮书》征求意见稿始出来
更新时间:2017-09-11 作者:中原医疗器械城

关于公开征求《中国上市药品目录集》框架意见的通知
发布日期:20170904
为落实《总局关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号)的要求,我中心按照总局领导指示组织起草了《中国上市药品目录集》(征求意见稿)。鉴于《中国上市药品目录集》尚处于制定起步阶段,当前收录内容与品种还很少,后续将随着新品种的收录而逐步增加和扩充相应内容。现公开征求对《中国上市药品目录集》基本框架结构与信息的意见和建议。我中心将根据意见和建议进一步完善。
征求意见截止时间至2017年9月15日。
联系人:李敏、闫方;电子邮箱:limin@cde.org.cn;yanf@cde.org.cn
国家食品药品监督管理总局药品审评中心
2017年9月4日
附件:中国上市药品目录集(征求意见稿)
目 录
一、前言5
二、使用指南7
(一)《中国上市药品目录集》收录的药品范围7
(二)药品目录7
(三)参比制剂和标准制剂7
(四)治疗等效相关术语8
(五)治疗等效性评价代码9
(六)附录10
(七)索引10
(八)RS上市许可持有人责任10
(九)药品监管机构责任10
(十)目录集的更新与完善10
(十一)示例12
三、药品目录14
品名目次14
头孢地尼胶囊(0.1g)15
甲磺酸伊马替尼片(0.1g)16
甲磺酸伊马替尼片(0.4g)17
甲磺酸伊马替尼胶囊(0.1g)18
西达本胺片(5mg)19
吉非替尼片(0.25g)20
吉非替尼片(0.25g)21
依非韦伦片(50mg)22
依非韦伦片(200mg)23
依非韦伦片(600mg)24
依非韦伦片(0.6g)25
苹果酸奈诺沙星胶囊(0.25g)26
注射用阿奇霉素(0.5g)27
注射用阿奇霉素(0.5g)28
注射用醋酸卡泊芬净(50mg)29
注射用醋酸卡泊芬净(70mg)30
注射用醋酸卡泊芬净(50mg)31
富马酸替诺福韦二吡呋酯片(300mg)32
富马酸替诺福韦二吡呋酯片(0.3g)33
四、附录34
附录1:给药途径34
附录2:剂型35
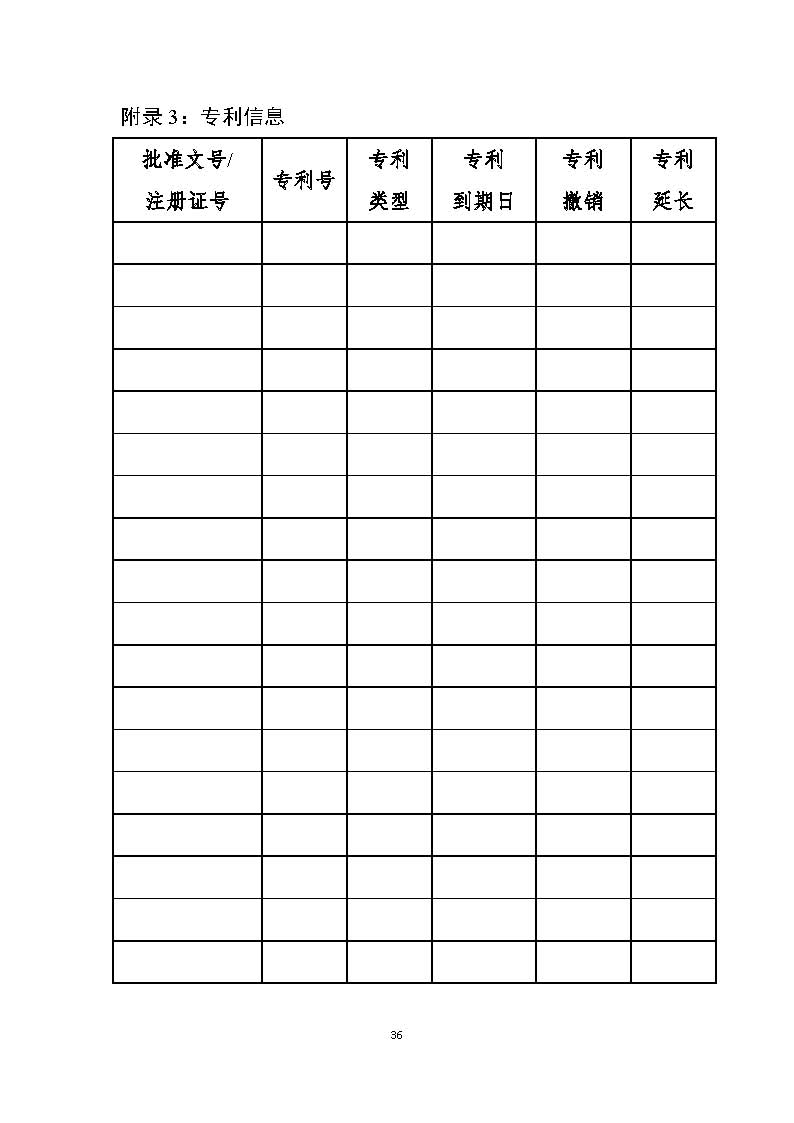
附录3:专利信息36
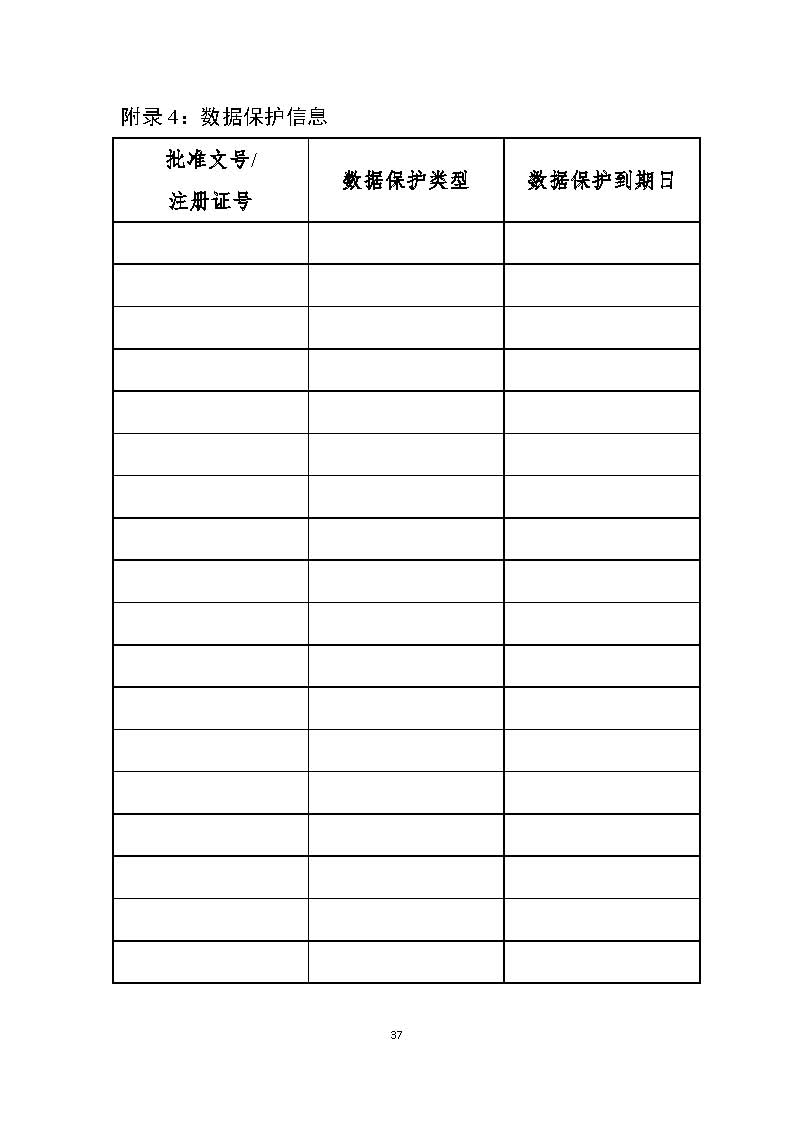
附录4:数据保护信息37
五、索引38
索引1:药品名称中文拼音索引38
索引2:活性成分中文拼音索引38
索引3:药品名称英文字母索引38
索引4:活性成分英文字母索引38
索引5:解剖学治疗学及化学分类系统代码(ATC代码)字母索引38
索引6:药品上市许可人名称拼音索引38
附件:39
一、前言
改革开放以来,我国制药产业快速、持续发展,有效解决了我国药品短缺的问题,人民群众的基本用药需求逐步得到满足。与此同时,公众对药品质量和创新药的需求也提出了更高的要求。
为深化药品审评审批制度改革,保护和促进公众健康,维护公众用药权益,降低用药负担,提高药品可及性;促进药物研发创新,保护专利权人合法权益;鼓励仿制药发展,提高仿制药质量,明确仿制药的标准,降低仿制药专利侵权风险;明确药品审评审批与创新药专利权人、仿制药申请人的责任与义务,探索建立药品专利链接、专利挑战、专利期限补偿及落实药品数据保护等制度;方便行业和公众及时、准确、全面了解上市药品的相关信息,借鉴国际经验、结合中国具体实际,国家食品药品监督管理总局组织制定了《中国上市药品目录集》,收录具有完整规范的安全性和有效性研究数据获得批准的创新药和改良型新药,以及具有药学等效和生物等效的仿制药品,并确定参比制剂和标准制剂。
《中国上市药品目录集》由前言、使用指南、药品目录、附录和索引五部分组成。使用指南主要介绍了目录集的使用说明、收录内容及相关术语的具体含义;药品目录则具体列出了药品的活性成分、药品名称、规格、剂型、参比制剂、生产厂商等基本信息;附录包含专利和数据保护等信息;索引帮助使用者检索信息。目录集实行动态管理,及时将新批准上市的药品纳入目录集,将存在安全风险和撤市的药品从目录集中调出。
《中国上市药品目录集》由国家食品药品监督管理总局在其官网以网络版(数据库)形式发布并实时更新;每年末发布电子版以便公众下载查询。
由于《中国上市药品目录集》尚属首次发布,许多不足之处将在工作当中逐步完善。请社会各界多提批评建议,以期更好地服务于公众健康和制药产业发展。
二、使用指南
(一)《中国上市药品目录集》收录的药品范围
《中国上市药品目录集》(以下简称“目录集”)收录以下药品:
1. 基于完整规范的安全性和有效性的研究数据获得批准的创新药、改良型新药及进口原研药品;
2. 按化学药品新注册分类批准的仿制药;
3. 通过质量和疗效一致性评价的药品;
4.国家食品药品监督管理总局(以下简称“食品药品监管总局”)确定的其他药品。
(二)药品目录
药品目录基本信息包括:活性成分、活性成分(英文)、药品名称、药品名称(英文)、商品名、商品名(英文)、剂型、给药途径、规格、参比制剂、标准制剂、治疗等效性评价代码、批准文号/注册证号、上市许可持有人、生产厂商、批准日期、上市状况、收录类别等(见示例)。食品药品监管总局官网目录集数据库药品目录中还链接有专利和数据保护信息等内容。
药品目录参照中华人民共和国药典根据活性成分的中文笔画顺序排列。对于复方制剂,以药品名称中的第一种活性成分的中文笔画顺序排列。
(三)参比制剂和标准制剂
参比制剂(Reference Listed Drug,简称RLD)是指在我国批准上市,并具有完整规范的安全性和有效性研究数据的药品。
对具有相同活性成分、剂型、给药途径、规格的药品,由于释药机理或适应症等不同,可确定为不同的RLD。
标准制剂(Reference Standard,简称RS)是指在我国批准上市,可用于生物等效性研究的对照药品。通常最大规格的RLD被确定为RS,如果最大规格在健康受试者中存在安全隐患或其他原因,可指定其他规格的RLD为RS。为保证RS的可获得性,必要时可确定其他的药品为RS。
RLD和RS由食品药品监管总局基于安全性、有效性和质量可控性的研究数据确定,必要时组织专家讨论。
(四)治疗等效相关术语
1.药学等效药品
药学等效药品应具有相同的活性成分、剂型、规格和给药途径,但形状、刻痕、释放机理、包装、辅料(包括着色剂、矫味剂、防腐剂)、有效期、说明书及贮藏条件等可能存在差异。
2.治疗等效药品
药学等效药品如果同时还具有生物等效,则是治疗等效药品,可认为具有与RS相同的临床有效性和安全性。但治疗等效药品也可能在一些其它特性上有所不同,如形状、刻痕、释放机理、包装、辅料(包括着色剂、矫味剂、防腐剂)、有效期、说明书及贮藏条件等。
(五)治疗等效性评价代码
设定治疗等效性评价代码(Therapeutic Equivalence Evaluations Code,简称TE代码)目的是能够让使用者快速了解收录的药品是否具有治疗等效及是否需要采用生物等效性试验确定治疗等效。
TE代码包含1至2个字母,首字母代表药学等效药品是否具有治疗等效性,第二个字母代表其他评价信息。
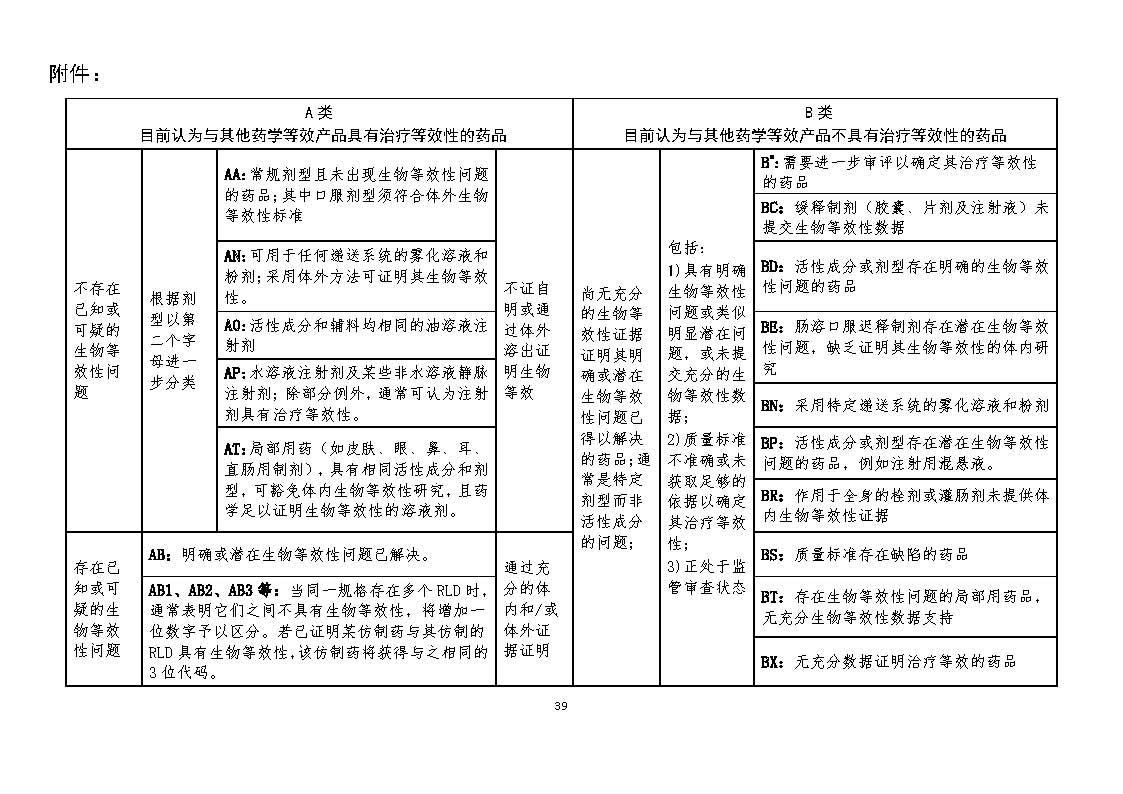
TE代码的首字母A或B分别代表两个类别:
A:可通过药学等效或生物等效评价方法确定具有治疗等效性,包括:
(1)不存在明确或潜在的生物等效性问题,标识为AX;
(2)存在明确或潜在生物等效性问题,但可通过药学等效和生物等效评价方法(充分的体内和/或体外研究数据)确定具有治疗等效性,标识为AB。
当同一规格存在多个RLD时,通常表明它们之间不具有生物等效性,TE代码将增加一位数字予以区分,如AB1、AB2等。若已证明某仿制药与其仿制的RLD具有生物等效性,该仿制药将获得与之相同的3位代码。
B:目前认为与其他药学等效药品不具有治疗等效性。
TE代码可根据研究和认识水平的变化,进行变更和调整(国际上已认同的TE代码类型见附件)。
通过仿制药质量与疗效一致性评价的改剂型药品、改规格药品和改盐基药品暂不标识TE代码。
(六)附录
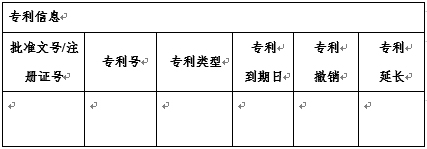
附录包括专业术语(如给药途径、剂型的缩写等)、专利信息、数据保护信息及食品药品监管总局认为适合公布的其他信息。
(七)索引
索引包括药品名称中文拼音索引、活性成分中文拼音索引、药品名称英文字母索引、活性成分英文字母索引、解剖学治疗学及化学分类系统代码(ATC代码)字母索引、药品上市许可人名称拼音索引等多种检索方式。
(八)RS上市许可持有人责任
1.应保证持续供应RS,不应拒绝向研发者提供RS,如存在供应短缺或不再销售,应至少提前6个月通知食品药品监管总局;
2.应提交RS的年度报告,内容包括年度质量回顾分析报告、销售信息以及作为RS的供应信息等。
(九)药品监管机构责任
1. 为保证RS的可获得性,食品药品监管总局应及时确定新的RS;
2. 应加大对RS的质量考核,全面了解RS的质量状况,督促RS上市许可持有人持续保持RS质量稳定。
(十)目录集的更新与完善
目录集将保持持续更新,确保内容准确,并建立网络版目录集,提供公开查询。
目录集相关管理机构联系方式:食品药品监管总局药品审评中心
联系人及电话:闫方010-68921505
电子邮箱:yanf@cde.org.cn
地址:北京市海淀区复兴路甲一号
(十一)示例
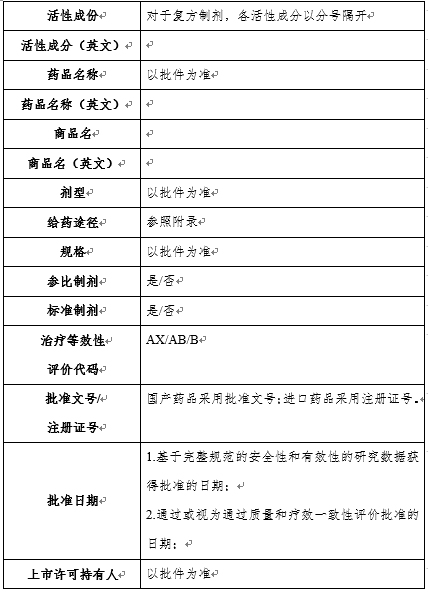
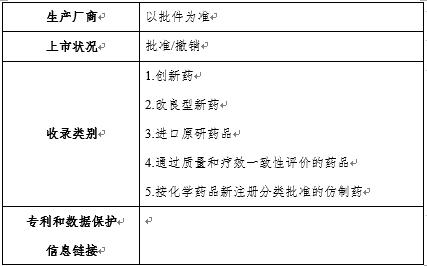
专利和数据保护所链接信息的具体形式:

三、药品目录
品名目次
(按药品名称笔画排列)